Динамика ширења инфекције (COVID-19)
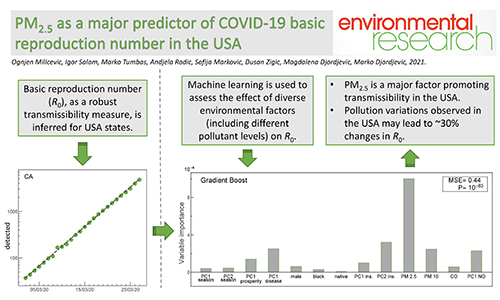
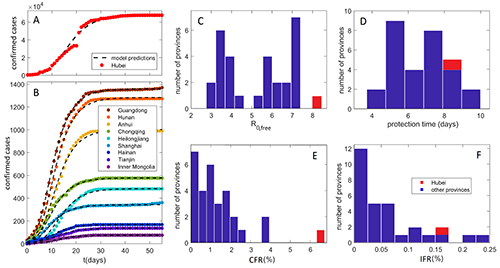
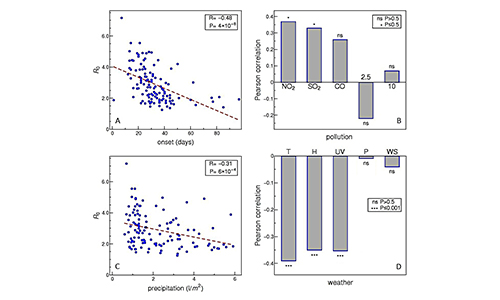
Користимо технике анализе података и моделовања из квантитативне биологије
да бисмо разумели преносивост и морталитет COVID-19 у популацији.
Циљ нам је да разумемо дуготрајно понашање болести у случају да постане ендемична,
укључујући разумевање фактора ризика за могуће будуће епидемије.
За више детаља, видите наше COVID-19 истраживање до сада.
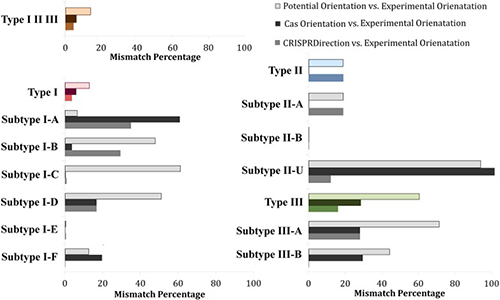
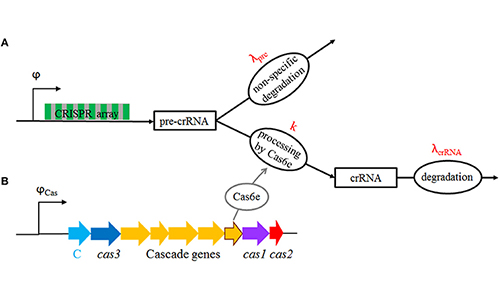
Моделовање CRISPR/Cas система
CRISPR/Cas је напредни имунски систем бактерија, који је револуционаризовао биотехнологију.
Како се овај систем, утишан под стандардним условима, активира?
Иако је тешко експериментално измерити динамику CRISPR/Cas система,
моделовањем можемо постићи доста боље разумевање,
при чему користимо комбинацију статистичке механике и моделовања динамичких система.
CRISPR/Cas је потенцијално моћна препрека за хоризонтални трансфер гена,
и моделовање његове регулације може помоћи да се боље разуме ширење гена везаних
за резистенцију на антибиотике и вируленцију.
Биоинформатичка анализа CRISPR/Cas система
У фокусу нашег истраживања су тзв. неканонске функције CRISPR/Cas система.
Постало је јасно да је систем укључен у регулацију експресије гена бактерија домаћина,
а који су углавном везани са вируленцијом. Пошто је систем активан под слабо окарактерисаним условима,
гени које регулише се тешко експериментално проналазе. Из тог разлога,
циљ нам је да развијамо биоинформатичке методе за предвиђање мета crRNA и CRISPR-асоцираних малих RNК.
Радимо и на повезаном проблему CRISPR/Cas адаптације,
односно анализи особина секвенци које омогућавају разликовање сопствене (бактерије домаћина)
од несопствене (вирусне) ДНК.
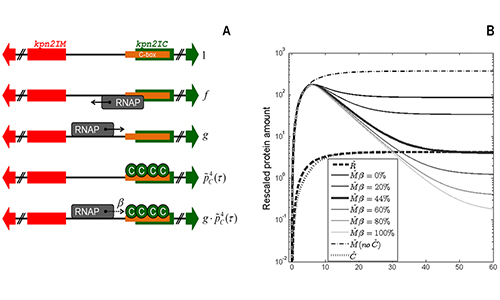
Робусност малих генских мрежа на промену брзине раста ћелија
Као модел користимо рестрикционо модификационе системе (Р-M) бактерија,
који се обично шире кроз хоризонтални трансфер гена.
Експресија рестрикционог ензима и метилазе мора да буде уско координисана у ћелији домаћину,
што се често остварује кроз специјализоване транскрипционе факторе.
Р-M системи се обично јављају са различитим архитектурама (конвергентне, дивергентне, линеарне),
при чему смо показали да су ове разлике конзистентне са пар општих ограничења
у регулацији експресије ових система. Наш циљ је да разумемо
у којој мери ове особине остају робусне у односу на промену услова раста ћелија
(и тиме унутарћелијских параметaрa).